Школьная энциклопедия. Энтропия. Второй закон термодинамики
В физике, так как она является точной наукой, большинство догм доказывается эмпирическим путем. Именно таким образом был выведен второй закон термодинамики, который сегодня изучается в каждой школе. Необратимость тепловых процессов - вот о чем он говорит. Стоит отметить, что на начальных этапах изучения такая трактовка куда более понятна.
Общие представления
Физическим принципом, который ограничивает направления различных процессов в термодинамических системах, является второй закон термодинамики. Определение данного термина было сформировано в 19 столетии, сначала Рудольфом Клаузисом, а затем Уильямом Томсоном (лордом Кельвином). В соответствии с двумя постулатами в мире не может существовать некий вечный двигатель второго рода. Нет и не будет такой установки, которая бы тепло, исходящее от всех вещей, живых существ и явлений, превращала в энергию для своей постоянной работы. Исходя из этого было выведено правило, что КПД не может равняться единице. Сравнить это можно с работой холодильника, где температура, допустим, будет равна абсолютному нулю. В таких условиях круговой обмен теплом исключен.
Формулировка Рудольфа Клаузиса
Первым озвучил второй закон термодинамики Р. Клаузис - немецкий физик-практик и математик. По его словам, круговой процесс, в котором результат достигается путем передачи теплоты от менее нагретого тела к более нагретому, невозможен. Иными словами, температура в полной или частичной мере может свободно переходить от более теплого тела к более охлажденному, но в обратном направлении этот процесс происходить не сможет. Это наглядным образом демонстрирует нам отсутствие цикличности, замкнутого круга. Такие понятия неприемлемы для термодинамики. Между телами просто происходит обмен теплом, и в результате этих действий не производится лишняя энергия.

Постулат, выведенный лордом Кельвином
Аналогичное определение второй закон термодинамики получил в трудах Томсона - британского физика и механика. Теоретически он звучит так: «Циклический процесс, единственным результатом которого могла бы быть работа, получаемая путем охлаждения теплого тела или резервуара, невозможен». Чтобы понять более ясно такую трактовку, представим себе некую машину (в соответствии с термодинамическим постулатом она существовать не может). Она периодически охлаждает резервуар с постоянно горячей водой, получая от этого тепловую энергию. За счет этой энергии машина поднимает различные грузы, как строительный кран. При этом в ней нет мотора, силовых установок и прочего механического наполнения. В точки зрения эмпирической физики такое невозможно.

Что общего?
Теперь рассмотрим, каким образом эти две трактовки объединяются и на что в принципе опирается второй закон термодинамики. Энтропия - та самая мера хаоса, которая увеличивается в процессе обмена теплом. Именно она является связующим элементом для описания Клаузиса и Кельвина. Но вернемся немного назад. Второе начало термодинамики гласит, что при обмене теплом энергия убывает (потому получение работы никак не возможно), но при этом мера хаоса увеличивается. Этот процесс необратимый, и часто его называют стихийным. В термодинамике энтропия постоянно приумножается, но ее уничтожение невозможно. Именно поэтому даже 100 процентов энергии, которые находятся в любом теле, не могут преобразоваться в работу.

Что такое мера хаоса?
Само понятие энтропии впервые было сформулировано устами Клаузиса. Оно применялось для определения меры необратимого процесса рассеивания энергии. Это была своего рода разница отклонения реального процесса от идеального. Энтропия в замкнутых системах, где любые процессы происходят циклично, имеет постоянную величину. Если же процесс необратимый (что непосредственно касается термодинамики), то энтропия всегда имеет положительное значение. Также стоит выделить, что мера хаоса порождается абсолютно всеми процессами, которые происходят во Вселенной. При постоянных показателях объема и энергии какого-либо тела или резервуара энтропия постоянно возрастает. Если данные показатели периодически меняются, то мера хаоса может уменьшиться за счет производимой работы, но ее полное уничтожение невозможно. При этом стоит отметить, что энтропия Вселенной не уменьшается. Она остается либо в норме, либо безвозвратно увеличивается.

Наглядный пример
Второй закон термодинамики можно объяснить на стандартном примере, который часто приводят школьникам. У нас есть два тела с различной температурой. Более нагретая субстанция будет отдавать свое тепло менее нагретой до тех пор, пока их температурные показатели не сравняются. В ходе данного процесса энтропия у первого, более теплого тела уменьшится на меньший показатель, нежели она увеличится у второго, более прохладного тела. В результате подобный самопроизвольный процесс создаст энтропию системы, показатель которой будет выше, чем суммарное значение энтропий двух тел в первоначальном положении. Иными словами, мера хаоса системы двух субстанций, полученная в результате обмена теплом, увеличилась.

Тепловая смерть Вселенной
Проводя свои расследования, Клаузис пришел к выводу, что каким бы открытым нам ни казалось пространство (наша планета, ее отдельные территории, акватории и т.д.), все это находится в космосе. Вселенная, в свою очередь, является огромнейшим замкнутым пространством, в рамках которого происходят макроскопические процессы. В силу того, что в замкнутой системе энтропия постоянно увеличивает свой показатель, наш мир близится к тому, что скоро в нем мера хаоса достигнет бесконечной величины. Это значит, что все процессы попросту прекратятся за счет того, что энергия исчерпает себя. Такая критическая точка, которой мы достигнем, возможно, в неком будущем, получила название тепловой смерти. Получается, что все наши действия (движения, ходьба, бег), все явления, которые происходят на планете (дуновение ветра, цунами, движения литосферных плит), - все это вызывает необратимое увеличение энтропии и исчерпывает энергию.
Опровержение теории
Судить обо всем космосе человек до сих пор не может. Мы видим лишь часть мира, в котором живем, и исследуем этот уголок, доказывая определенные законы и формируя на основе этого свои представления. Потому первое опровержение возможности тепловой смерти, которая основана на втором законе термодинамики, заключается в том, что Вселенная может и не быть замкнутой системой. Доподлинно известно, что 85 процентов космоса состоит из антиматерии, свойства которой никому неизвестны. Второе опровержение заключается в том, что наш космос, даже если и замкнут, является сплошной флуктуацией. Из-за различных колебаний и смен размеров, масс, показателей энергии и температуры энтропия не увеличивается (в суммарном, вселенском значении) и не уменьшается. Следовательно, мы и так пребываем в состоянии термодинамического равновесия, или же, словами Клаузиса, в состоянии тепловой смерти.
Подводим итоги
Второй закон термодинамики неразрывно связан с развитием точных наук. Он был открыт на заре научно-технического прогресса и стал, можно сказать, отправной точкой для дальнейших работ ученых в области математики, физики и астрономии. Стоит отметить, что все это мы представляем сугубо в земных условиях. Вполне вероятно, что в другой среде, где гравитационные поля имеют иную силу, термодинамика будет работать по совсем другой схеме.
Министерство образования и науки Российской Федерации
Государственной образовательное учреждение высшего профессионального образования
Ивановский государственный химико-технологический университет
Кафедра Технологии пищевых продуктов и биотехнологии (ТППиБТ)
Реферат
по дисциплине «Техническая термодинамика и теплотехника»
II -ой закон термодинамики или «Тепловая смерть Вселенной»
Выполнил:
студент 3 курса
Ивлев Павел Андреевич
Руководитель:
к т н, доцент, кафедры ПиАХТ
Маркичев Николай Аркадьевич
Иваново 2010 г.
Введение__________________________________________________________________ 3
Часть 1. Второй закон термодинамики.
1.1. Второй закон термодинамики. Характеристика и формулировка._______________4
Часть 2. Энтропия
2.1. Понятие энтропии.______________________________________________________5
2.2. Закон возрастания энтропии. Вывод закона возрастания энтропии.______________5
2.3 Возможность энтропии во Вселенной.______________________________________6
Часть 3. Теория «тепловой смерти» Вселенной
3.1. Появление идеи Теории «тепловой смерти» Вселенной._______________________8
3.2. Взгляд на Теорию «тепловой смерти» Вселенной из ХХ века.__________________9
3.3 «За» и «против» Теории «тепловой смерти» Вселенной_______________________10
Заключение_______________________________________________________________16
Список, использованной в работе литературы __________________________________17
Введение:
В данной работе поднимаеться проблема о будущем нашей Вселенной. О будущем очень далеком, настолько, что неизвестно, наступит ли оно вообще. Жизнь и развитие науки существенно меняют наши представления и о Вселенной, и об ее эволюции, и о законах, управляющих этой эволюцией. В самом деле, существование черных дыр было предсказано еще в XVIII веке. Но лишь во второй половине XX столетия их стали рассматривать как гравитационные могилы массивных звезд и как места, куда может навечно «провалиться» значительная часть вещества, доступного наблюдениям, выбывая из общего круговорота. А позже стало известно, что черные дыры испаряются и, таким образом, возвращают поглощенное, хотя совсем в другом обличие. Новые идеи постоянно высказываются космофизиками. Поэтому картины, нарисованные еще совсем недавно, неожиданно оказываются устаревшими.
Одним из наиболее дискуссионных вот уже около 100 лет является вопрос о возможности достижения равновесного состояния во Вселенной, что эквивалентно понятию ее «тепловой смерти», причиной которой являеться Второй закон термодинамики и истекающие из него выводы.
Часть1. Второй закон термодинамики
Второй закон термодинамики. Характеристика и формулировка:
Естественные процессы всегда направлены в сторону достижения системой равновесного состояния (механического, термического или любого другого). Это явление отражено вторым законом термодинамики, имеющим большое значение и для анализа работы теплоэнергетических поцессов.
Второе начало термодинамики - физический принцип, накладывающий ограничение на направление процессов передачи тепла между телами. Он гласит, что невозможен самопроизвольный переход тепла от тела, менее нагретого, к телу, более нагретому.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая невозможность перехода всей внутренней энергии системы в полезную работу.
Второе начало термодинамики является постулатом, не доказываемым в рамках термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
Существуют формулировоки:
- передача теплоты от холодного источника к горячему невозможна без затраты работы;
- невозможно построить периодически действующую машину, совершающую работу и соответственно охлаждающую тепловой резервуар;
- природа стремится к переходу от менее вероятных состояний к более вероятным.
Следует подчеркнуть, что второй закон термодинамики (так же как и первый), сформулирован на основе опыта. В наиболее общем виде второй закон термодинамики может быть сформулирован следующим образом: любой реальный самопроизвольный процесс является необратимым. Все прочие формулировки второго закона являются частными случаями наиболее общей формулировки:
невозможен процесс, при котором теплота переходила бы самопроизвольно от тел более холодных к телам более теплым (постулат Клаузиуса, 1850 г.).
В.Томсон (лорд Кельвин) предложил в 1851 г. следующую формулировку: невозможно при помощи неодушевленного материального агента получить от какой-либо массы вещества механическую работу посредством охлаждения ее ниже температуры самого холодного из окружающих предметов.
М.Планк предложил формулировку более четкую, чем формулировка Томсона: невозможно построить периодически действующую машину, все действие которой сводилось бы к понятию некоторого груза и охлаждению теплового источника.
Часть 2. Энтропия
2.1 Понятие энтропии.
Несоответствие между превращением теплоты в работу и работы в теплоту приводит к односторонней направленности реальных процессов в природе, что и отражает физический смысл второго начала термодинамики в законе о существовании и возрастании в реальных процессах некой функции, названной энтропией , определяющей меру обесценения энергии.
Часто второе начало термодинамики преподносится как объединенный принцип существования и возрастания энтропии.
Принцип существования энтропии формулируется как математическое выражение энтропии термодинамических систем в условиях обратимого течения процессов:
Принцип возрастания энтропии сводится к утверждению, что энтропия изолированных систем неизменно возрастает при всяком изменении их состояния и остается постоянной лишь при обратимом течении процессов:
 .
.
Оба вывода о существовании и возрастании энтропии получаются на основе какого-либо постулата, отражающего необратимость реальных процессов в природе. Наиболее часто в доказательстве объединенного принципа существования и возрастания энтропии используют постулаты Р.Клаузиуса, В.Томпсона-Кельвина, М. Планка
2 .2.
Закон возрастания энтропии. Вывод закона
возрастания энтропии.
.2.
Закон возрастания энтропии. Вывод закона
возрастания энтропии.
Применим неравенство Клаузиуса для описания необратимого кругового термодинамического процесса, изображенного на рис 1.
Рисунок 1. Необратимый круговой термодинамический процесс
Пусть процесс 1-2 будет необратимым, а 2-1 процесс - обратимым. Тогда неравенство Клаузиуса для этого случая примет вид

Так как процесс 2-1 является обратимым, тогда

Подстановка этой формулы в неравенство (1) позволяет получить выражение

Сравнение выражений (1) и (2) позволяет записать следующее неравенство

в котором знак равенства имеет место в случае, если процесс 1-2 является обратимым, а знак больше, если процесс 1-2 - необратимый.
Неравенство (3) может быть также записано и в дифференциальной форме

Если рассмотреть адиабатически изолированную термодинамическую систему, для которой, то выражение (4) примет вид

или в интегральной форме

Полученные неравенства выражают собой закон возрастания энтропии, который можно сформулировать следующим образом:
В адиабатически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
2.3 Возможность энтропии во Вселенной
В адиабтически изолированной термодинамической системе энтропия не может убывать: она или сохраняется, если в системе происходят только обратимые процессы, или возрастает, если в системе протекает хотя бы один необратимый процесс.
Записанное утверждение является ещё одной формулировкой второго начала термодинамики.
Таким образом, изолированная термодинамическая система стремится к максимальному значению энтропии, при котором наступает состояние термодинамического равновесия.
Необходимо отметить, что если система не является изолированной, то в ней возможно уменьшение энтропии. Примером такой системы может служить, например, обычный холодильник, внутри которого возможно уменьшение энтропии. Но для таких открытых систем это локальное понижение энтропии всегда компенсируется возрастанием энтропии в окружающей среде, которое превосходит локальное ее уменьшение.
С законом возрастания энтропии непосредственно связан парадокс, сформулированный в 1852 году Томсоном (лордом Кельвином) и названый им гипотезой тепловой смерти Вселенной. Подробный анализ этой гипотезы был выполнен Клаузиусом, который считал правомерным распространение на всю Вселенную закона возрастания энтропии. Действительно, если рассмотреть Вселенную как адиабатически изолированную термодинамическую систему, то, учитывая ее бесконечный возраст, на основании закона возрастания энтропии можно сделать вывод о достижении ею максимума энтропии, то есть состояния термодинамического равновесия. Но в реально окружающей нас Вселенной этого не наблюдается.
Часть 3. Теория «тепловой смерти» Вселенной.
Тепловая смерть Вселенной (Т.С.В.) - это вывод о том, что все виды энергии во Вселенной в конце концов должны перейти в энергию теплового движения, которая равномерно распределится по веществу Вселенной, после чего в ней прекратятся все макроскопические процессы.
Этот вывод был сформулирован Р. Клаузиусом (1865) на основе второго начала термодинамики. Согласно второму началу, любая физическая система, не обменивающаяся энергией с другими системами (для Вселенной в целом такой обмен, очевидно, исключен), стремится к наиболее вероятному равновесному состоянию - к так называемому состоянию с максимумом энтропии. ... , «Аналитики» (I и II ) и др.; 3) ... закон исключенного тетьего (А или не – А, т.е. или А истинно, или ... очки" ... тепловой смерти Вселенной . Неуничтожимость материи нельзя понимать только в количественном отношении. Законы ... законы Кеплера, законы термодинамики , законы ...
Коцепции физики
Реферат >> ФизикаГидростатика Архимеда (III- II в. до н.э.) ... XIII веке очков , но... или начал, являющихся обобщением результатов многочисленных наблюдений и экспериментов. б) Первое начало термодинамики (закон ... формированию концепции "тепловой смерти" вселенной . Ее суть...
Физическая химия: конспект лекций Березовчук А В
5. Процессы. Второй закон термодинамики
Второй закон термодинамики, в отличие от первого закона термодинамики, изучает все процессы, которые протекают в природе, и эти процессы можно классифицировать следующим образом.
Процессы бывают самопроизвольные, несамопроизвольные, равновесные, неравновесные.
Самопроизвольные процессы делятся на обратимые и необратимые. Второй закон термодинамики называют законом направленности процесса в изолированной системе (закон роста S). Слово «энтропия» создано в 1865 г. Р. Ю. Э. Клаузиусом – «тропе» с греческого означает превращение. В 1909 г. профессор П. Ауербах назвал царицей всех функций внутреннюю энергию, а S – тенью этой царицы. Энтропия – мера неупорядоченности системы.
Обратимые и необратимые процессы
Необратимые процессы идут без затраты работы, протекают самопроизвольно лишь в одном направлении, это такие изменения состояния в изолированной системе, когда при обращении процессов свойства всей системы меняются. К ним относятся:
1) теплопроводность при конечной разности температур;
2) расширение газа при конечной разности давлений;
3) диффузия при конечной разности концентраций.
Обратимыми процессами в изолированной системе называются такие процессы, которые можно обратить без каких-либо изменений в свойствах этой системы.
Обратимые: механические процессы в системе, где отсутствует трение (идеальная жидкость, ее движение, незатухающие колебания маятника в вакууме, незатухающие электромагнитные колебания и распространение электромагнитных волн там, где нет поглощения), которые могут возвратиться в начальное состояние.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, Na с большой скоростью движется по поверхности, так как идет выделение водорода проверить.).
Несамопроизвольные
Равновесие делится на устойчивое, неустойчивое и безразличное .
1. Постулат Клаузиуса – не может быть перехода тепла от менее нагретого к более нагретому телу.
2. Постулат Томсона – теплота наиболее холодного тела не может служить источником работы.
Теорема Карно – Клаузиуса: все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела.
Q 1 /Т 1 –
Q 2 / T 2 –
Q 1 /Т 1 = Q 2 /Т 2 –


![]()
Это четвертое уравнение второго закона термодинамики Если процесс является замкнутым, то
При необратимом процессе:
Это шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0.
S.
S = k lnW.
Действие, обратное логарифму – потенцирование :
Первый закон термодинамики определяется постоянством функции U в изолированной системе. Найдем функцию, выражающую содержание второго закона, а именно, одностороннюю направленность протекающих в изолированной системе процессов. Изменение искомой функции должно иметь для всех реальных, т. е. необратимых процессов, протекающих в изолированных системах, один и тот же знак. Второй закон термодинамики в приложении к некруговым необратимым процессам должен выражатся неравенством. Вспомним Цикл Карно. Так как любой цикл можно заменить бесконечно большим числом бесконечно малых циклов Карно, то выражение:
![]()
справедливо для любого обратимого цикла. Считая на каждом элементарном участке теплообмена Т = const, найдем, что:
![]()
и для всего цикла

Энергия Гельмгольца Изохорно-изотермический потенциал
F = U – TS
Величина (V – TS ) является свойством системы; она называется энергией Гельмгольца . Была введена Гельмгольцем в 1882 г.
dF = dU – TdS – SdT,
U = F + TS,
dF = TdS – pdV – SdT,
F – полный дифференциал.

Увеличение объема приводит к тому, что изохорно-изотермический потенциал уменьшается (тот «минус», который стоит перед Р). Повышение температуры приводит к тому, что F уменьшается.
?А равн > ?А неравн
Q = ?U + A,
A = Q – ?U,
A = T(S 2 – S 1) – (U 2 – U 1),
А = F 1 – F 2 = – ?F,
А равн = – ?F –
физический смысл изохорно-изотермического потенциала.
Убыль изохорно-изотермического потенциала равна максимальной работе, производимой системой в этом процессе; F – критерий направленности самопроизвольного процесса в изолированной системе . Для самопроизвольного процесса: AF T г < 0.
Для несамопроизвольного процесса: ?F T,V > 0. Для равновесного процесса: ?F T,V = 0.
?F V,T ? 0.
Изохорно-изотермический потенциал в самопроизвольных процессах уменьшается и, когда он достигает своего минимального значения, то наступает состояние равновесия (рис. 4).

Рис. 4
2 – несамопроизвольный процесс;
3 – равновесный процесс.
Изобарно-изотермический потенциал .
1) G (P, Т= cоnst), энергия Гиббса
G = U – TS + PV = H – TS = F + PV,
?Q = dU – Pdv + A?,
?A? = Q – dU – pdv,
?A? max = T(S 2 – S 1) – (U 2 – U 1) – p(V 2 – V 1),
?A? max = (U 1 – TS 1 + PV 1) – (U 2 – TS 2 + PV 2) = G 1 – G 2 = – ?G,
U – TS + pV = G,
A? max = – ?G.
Работа изобарно-изотермического процесса равна убыли изобарно-изотермического потенциала – физический смысл этой функции;
2) функция – полный дифференциал, однозначна, конечна, непрерывна.
G = U – TS + pV,
dG = dU – TdS – SdT + pdv + vdp,
dG = TdS – pdV – TdS – SdT + pdv + vdp,
dG = –SdT + Vdp,
Повышение температуры приводит к тому, что изобарно-изотермический потенциал уменьшается, так как перед S стоит знак «минус». Повышение давления приводит к тому, что изобарно-изотермический потенциал увеличивается, так как перед V стоит знак «плюс»;
3) G как критерий направленности процесса в изолированной системе.
Для самопроизвольного процесса: (?G ) P,T < 0. Для несамопроизвольного процесса: (?G ) P,T > 0. Для равновесного процесса: (?G) P,T = 0
?G (P, T) ? 0.
Изобарно-изотермический потенциал в самопроизвольных процессах уменьшается, и, когда он достигает своего минимума, то наступает состояние равновесия.
Рис. 5
где 1 – самопроизвольный процесс;
2 – равновесный процесс;
3 – несамопроизвольный процесс.
Совершается работа за счет?U и?H .
Противодействующие факторы. Энтальпийный фактор характеризует силу притяжения молекул. Энтропийный фактор характеризует стремление к разъединению молекул.
Энтальпия – Н Внутренняя энергия – U.
H = U + PV,
dH = dU + pdv + vdp,
U = TS – PV,
dU = TdS – SdT + pdV + Vdp,
dH = –pdV + pdV + Vdp; U = TdS + VdP.

Рис. 6
где 1 – самопроизвольный процесс,
2 – несамопроизвольный процесс,
3 – равновесный процесс,
(dH) P,T ? 0,
(dU) S,T ? 0.
Уравнения Гиббса – Гельмгольца – уравнения максимальной работы .
Они позволяют установить связь между максимальной работой равновесного процесса и теплотой неравновесного процесса

уравнение Гельмгольца (уравнение связывающее функции F и G

![]()
уравнение Гиббса (уравнение связывающее функции F и G с их температурными производными).
Уравнение Клаузиуса-Клапейрона
Оно позволяет применить второй закон термодинамики к фазовым переходам. Если рассчитать процессы, в которых совершается только работа расширения, то тогда изменение внутренней энергии
U 2 – U 1 = T(S 2 – S 1) – P(V 2 – V 1),
(U 1 – TS 1 + PV 1) = (U 2 – TS 2 + PV 2),
G 1 = G 2 – в условиях равновесия.
Предположим, что 1 моль вещества переходит из первой фазы во вторую.
I фаза => dG 1 = V 1 dp – S 1 dT.
II фаза => dG 2 = V 2 dp – S 2 dT, при равновесии dG 2 – dG 1 = 0
dG 2 – dG 1 = dp(V 2 – V 1) – dT(S 2 – S1) –
нет условного равновесия,
где dP/dT – температурный коэффициент давления,
где ? фп – теплота фазового перехода.
![]()
уравнение Клаузиуса-Клапейрона, дифференциальная форма уравнения.
Уравнение устанавливает взаимосвязь между теплотой фазового перехода, давлением, температурой и изменением молярного объема.
![]()
эмпирическая форма уравнения Клаузиуса-Клапейрона.

Рис. 7
Рис. 8
Уравнение Клаузиуса-Клапейрона изучает фазовые переходы. Фазовые переходы могут быть I рода и II рода.
I рода – характеризуются равенством изобарных потенциалов и скачкообразными изменениями S и V.
II рода – характеризуются равенством изобарных потенциалов, равенством энтропий и равенством молярных объемов.
I рода – ?G = 0, ?S ? 0, ?V ? 0.
II рода – ?G = 0, ?S = 0, ?V = 0.
Алгебраическая сумма приведенных теплот для любого обратимого кругового процесса равна нулю.
Эта подынтегральная величина – дифференциал однозначной функции состояния. Эта новая функция была введена Клаузиусом в 1865 г. и названа энтропией – S (от греч. «превращение»).
Любая система в различном состоянии имеет вполне определенное и единственное значение энтропии, точно так же, как определенное и единственное значение Р, V, T и других свойств.
Итак, энтропия выражается уравнением:
где S – это функция состояний, изменение которой dSв обратимом изотермическом процессе перехода теплоты в количество Q равно приведенной теплоте процесса.
При независимых переменных U (внутренняя энергия) может обозначаться U ВН и V (объем), или Р (давление) и Н (энтальпия). Энтропия является характеристической функцией. Характеристические функции – функции состояния системы, каждая из которых при использовании ее производных дает возможность выразить в явной форме другие термодинамические свойства системы. Напомним, в химической термодинамике их пять:
1) изобарно-изотермический потенциал (энергия Гиббса) при независимых переменных Т, Р и числе молей каждого из компонентов и. ;
2) изохорно-изотермический потенциал (энергия Гельмгольца) при независимых переменных Т, V, n i ;
3) внутренняя энергия при независимых переменных: S, V, n i ;
4) энтальпия при независимых переменных: S, Р, п i ;
5) энтропия при независимых переменных Н, Р, n i . .
В изолированных системах (U и V= const) при необратимых процессах энтропия системы возрастает, dS > 0; при обратимых – не изменяется, dS = 0.
Связь энтропии с другими термодинамическими параметрами
Для того, чтобы решить конкретную задачу, связанную с применением энтропии, надо установить зависимость между ней и другими термодинамическими параметрами. Уравнение dS = ?Q/T в сочетании с?Q = dU + PdV и?Q = dH – VdP дает уравнения:
dU = TdS – PdV,
dH = TdS + VdP.
Записав уравнение:

применительно к функциональной зависимости ?(Т, V, S) = 0, получим

Теперь найдем зависимость энтропии от температуры из уравнений:

Вот эти зависимости:
Эти два уравнения являются практически наиболее важными частными случаями общего соотношения:
TdS = CdT.
Пользуясь разными зависимостями, можно вывести другие уравнения, связывающие термодинамические параметры.
Самопроизвольные – процессы, которые идут сами собой, на них не затрачивается работа, они сами могут производить ее (движение камней в горах, натрий с большой скоростью движется по поверхности, так как идет выделение водорода), а калий буквально «прыгает» по воде.
Несамопроизвольные – процессы, которые не могут идти сами собой, на них затрачивается работа.
Равновесие делится на устойчивое, неустойчивое и безразличное.
Постулаты второго закона термодинамики.
1. Постулат Клаузиуса – «Не может быть перехода тепла от менее нагретого к более нагретому телу».
2. Постулат Томсона – «Теплота наиболее холодного тела не может служить источником работы».
Теорема Карно-Клаузиуса: «Все обратимые машины, совершающие цикл Карно с участием одного и того же нагревателя и одного и того же холодильника, имеют одинаковый коэффициент полезного действия, независимо от рода рабочего тела».
Аналитические выражения второго закона термодинамики.
1. Классическое уравнение второго закона термодинамики

где Q /Т – приведенное тепло;
Q 1 /Т 1 – приведенное тепло нагревателя;
Q 2 / T 2 – приведенное тепло холодильника;
Q 1 /Т 1 = Q 2 / T 2 – равенство приведенных теплот нагревателя и холодильника. Это второе уравнение термодинамики.
Если делим адиабатами на множество циклов Карно, то получим

Это третье уравнение второго закона термодинамики для бесконечно малого цикла Карно.
Если процесс является конечным, то
![]()
Это четвертое уравнение второго закона термодинамики
Если процесс является замкнутым, то
Это пятое уравнение второго закона термодинамики для обратимого процесса.
Интеграл по замкнутому контуру – интеграл Клаузиуса.
При необратимом процессе:
шестое уравнение второго закона термодинамики, или уравнение Клаузиуса, для обратимого процесса равно нулю, для необратимого процесса оно меньше 0, но иногда может быть больше 0.
это седьмое уравнение второго закона термодинамики. Второй закон термодинамики – закон роста S.
S = k lnW.
S = k lnW –
это формула Больцмана,
где S – энтропия – степень разупорядоченности системы;
k– постоянная Больцмана;
W – термодинамическая вероятность системы макросостояний.
Термодинамическая вероятность – число микросостояний данной системы, с помощью которых можно реализовать данное макросостояние системы (Р, Т, V).
Если W = 1, то S = 0, при температуре абсолютного нуля –273°С все виды движений прекращаются.
Термодинамическая вероятность – это число способов, которыми атомы и молекулы можно распределить в объеме.
Из книги Медицинская физика автора Подколзина Вера Александровна25. Второе начало термодинамики. Энтропия Существует несколько формулировок второго закона термодинамики: теплота сама собой не может переходить от тела с меньшей температурой к телу с большей температурой (формулировка Клаузиуса), или невозможен вечный двигатель
Из книги Физическая химия: конспект лекций автора Березовчук А В29. Физические процессы в биологических мембранах Важной частью клетки являются биологические мембраны. Они отграничивают клетку от окружающей среды, защищают ее от вредных внешних воздействий, управляют обменом веществ между клеткой и ее окружением, способствуют
Из книги Новейшая книга фактов. Том 3 [Физика, химия и техника. История и археология. Разное] автора Кондрашов Анатолий Павлович3. Первый закон термодинамики. Калорические коэффициенты. Связь между функциями CP и Cv Формулировки первого закона термодинамики.1. Общий запас энергии в изолированной системе остается постоянным.2. Разные формы энергии переходят друг в друга в строго эквивалентных
Из книги Атомная энергия для военных целей автора Смит Генри Деволф2. Электродные процессы Электродные процессы – процессы, связанные с переносом зарядов через границу между электродом и раствором. Катодные процессы связаны с восстановлением молекул или ионов реагирующего вещества, анодные – с окислением реагирующего вещества и с
Из книги Курс истории физики автора Степанович Кудрявцев Павел3. Катодные и анодные процессы в гальванотехнике Основными процессами в гальванотехнике являются восстановление и снижение.На Kat – восстановление, где Kat – катод. На An – снижение, где An – анод.Электролиз H2O: Катодные реакции Последняя реакция протекает свыделением
Из книги История лазера автора Бертолотти Марио4. Стохастические процессы и самоорганизующиеся системы Стохастические процессы и самоорганизующиеся системы являются предметом изучения электрохимической синергетики. Такие процессы имеют место во всех областях: переход от ламинарного к турбулентному процессу,
Из книги Вечный двигатель - прежде и теперь. От утопии - к науке, от науки - к утопии автора Бродянский Виктор МихайловичЛЕКЦИЯ № 15. Третий закон термодинамики Понятие химического сродства. Известно, что многие вещества реагируют друг с другом легко и быстро, другие вещества реагируют с трудом, а третьи – не реагируют. Исходя из этого, вывели предположение, что между веществами существует
Из книги 4. Кинетика. Теплота. Звук автора Фейнман Ричард Филлипс Из книги Механика от античности до наших дней автора Григорьян Ашот ТиграновичКАСКАДНЫЕ И КОМБИНИРОВАННЫЕ ПРОЦЕССЫ 9.32. Во всех статистических методах разделения изотопов для получения вещества, содержащего 90 % или больше U-235 или дейтерия, необходимо много последовательных ступеней разделения. Если поток движется непрерывно от одной ступени к
Из книги автораВозникновение и развитие термодинамики. Карно Если в XVIII в. в физике (за исключением механики) господствовал эксперимент, так что физику определяли как науку «о всем том, что через опыты познать можно», то в XIX в. картина начинает меняться. Экспериментальная физика
Из книги автораВторое начало термодинамики Прогресс теплотехники не только стимулировал открытие закона сохранения и превращения энергии, но и двинул вперед теоретическое изучение тепловых явлений. Уточнялись основные понятия, создавалась аксиоматика теории теплоты,
Из книги автораВторой твердотельный лазер В сентябре 1959 г. Таунс организовал конференцию «Квантовая электроника - резонансные явления», на которой, хотя лазер еще не был создан, большинство неформальных дискуссий концентрировалось на лазерах.В этой конференции приняли участие Петер
Из книги автораГлава третья. ИДЕЯ ppm-2 и ВТОРОЙ ЗАКОН ТЕРМОДИНАМИКИ У кого не уяснены принципы во всей логической полноте и последовательности, у того не только в голове сумбур, но и в делах чепуха. Н. Г.
Из книги автора Из книги автораГлава 45 ПРИМЕРЫ ИЗ ТЕРМОДИНАМИКИ § 1. Внутренняя энергия§ 2. Применения§ 3. Уравнение Клаузиуса –Клайперона§ 1. Внутренняя энергияКогда приходится использовать термодинамику для дела, то оказывается, что она очень трудный и сложный предмет. В этой книге, однако, мы не
Из книги автораIX. МЕХАНИКА В РОССИИ ВО ВТОРОЙ ПОЛОВИНЕ XIX-НАЧАЛЕ XX
Как генерируется энергия, как она преобразуется из одной формы в другую и что происходит с энергией в замкнутой системе? На все эти вопросы помогут дать ответ законы термодинамики. Подробнее сегодня будет рассмотрен второй закон термодинамики.
Законы в повседневной жизни
Законы управляют повседневной жизнью. В дорожных законах говорится, что нужно остановиться на знаках остановки. Правительственные требуют предоставить часть своей зарплаты государству и федеральному правительству. Даже научные применимы к повседневной жизни. Например, закон силы тяжести предсказывает довольно плохой результат для тех, кто пытается летать. Другой набор научных законов, которые влияют на повседневную жизнь, - это законы термодинамики. Итак, можно привести ряд примеров, чтобы увидеть, как они влияют на повседневную жизнь.
Первый закон термодинамики
Первый закон термодинамики гласит, что энергия не может быть создана или уничтожена, но можно преобразовать ее из одной формы в другую. Это также иногда называют законом сохранения энергии. Итак, как это относится к повседневной жизни? Ну, взять, к примеру, компьютер, который вы используете сейчас. Он питается энергией, но откуда эта энергия? Первый закон термодинамики говорит нам, что эта энергия не могла появиться из-под воздуха, поэтому она откуда-то появилась.
Можно отследить эту энергию. Компьютер питается от электричества, но откуда это электричество? Правильно, с электростанции или гидроэлектростанции. Если рассматривать вторую, то она будет связана с плотиной, которая сдерживает реку. У реки есть связь с кинетической энергией, а это означает, что река течет. Плотина превращает эту кинетическую энергию в потенциальную энергию.
Как работает гидроэлектростанция? Вода используется для вращения турбины. При вращении турбины приводится в действие генератор, который будет создавать электричество. Это электричество может быть проложено полностью в проводах от электростанции до вашего дома, чтобы при подключении шнура питания к электрической розетке электричество проникало в ваш компьютер, чтобы он мог работать.
Что произошло здесь? Уже было определенное количество энергии, которая была связана с водой в реке как кинетическая энергия. Потом она превратилась в потенциальную энергию. Затем плотина приняла эту потенциальную энергию и превратила ее в электричество, которое затем смогло попасть в ваш дом и привести в действие компьютер.
Второй закон термодинамики
Изучив этот закон, можно понять, как работает энергия и почему все движется к возможному хаосу и беспорядку. Второй закон термодинамики еще называют законом энтропии. Вы когда-нибудь задумывались, как возникла Вселенная? Согласно Теории Большого Взрыва, до того, как зародилось все вокруг, вместе собралось огромное количество энергии. После Большого Взрыва появилась Вселенная. Все это хорошо, только что это была за энергия? В начале времени вся энергия во Вселенной содержалась в одном относительно небольшом месте. Эта интенсивная концентрация представляла собой огромное количество того, что называется потенциальной энергией. Со временем она распространилась по огромному пространству нашей Вселенной.
В гораздо меньших масштабах резервуар воды, удерживаемый плотиной, содержит потенциальную энергию, так как ее расположение дает возможность протекать через плотину. В каждом случае запасенная энергия, однажды выпущенная, распространяется и делает это без каких-либо прилагаемых усилий. Другими словами, высвобождение потенциальной энергии является спонтанным процессом, который возникает без необходимости в дополнительных ресурсах. По мере того, как энергия распространяется, часть ее преобразуется в полезную и выполняет определенную работу. Остальная преобразуется в непригодную, просто называемую теплотой.
Поскольку Вселенная продолжает распространяться, она содержит все менее и менее полезную энергию. Если менее полезная доступна, меньше работы может быть сделано. Так как вода течет через плотину, она также содержит менее полезную энергию. Это уменьшение полезной энергии с течением времени называется энтропией, где энтропия - это количество неиспользуемой энергии в системе, а система - это просто совокупность объектов, составляющих целое.
Энтропия также может упоминаться как количество случайностей или хаоса в организации без организации. По мере того как полезная энергия уменьшается с течением времени, дезорганизация и хаос увеличиваются. Таким образом, по мере освобождения накопленной потенциальной энергии не все это преобразуется в полезную. Все системы испытывают это увеличение энтропии с течением времени. Это очень важно понять, и это явление называют вторым законом термодинамики.

Энтропия: случайность или дефект
Как вы, возможно, догадались, второй закон следует за первым, который обычно называют законом сохранения энергии, и он утверждает, что энергия не может быть создана и ее нельзя уничтожить. Другими словами, количество энергии во Вселенной или любой системе является постоянным. Второй закон термодинамики обычно называют законом энтропии, и он считает, что с течением времени энергия становится менее полезной, а качество ее уменьшается со временем. Энтропия - это степень случайности или дефектов, которые имеет система. Если система очень неупорядоченная, то она обладает большой энтропией. Если в системе много неисправностей, то энтропия низкая.
Говоря простыми словами, второй закон термодинамики гласит, что энтропия системы не может со временем уменьшаться. Это означает, что в природе вещи переходят от состояния порядка к состоянию беспорядка. И это необратимо. Система никогда не станет более упорядоченной сама по себе. Другими словами, в природе энтропия системы всегда увеличивается. Один из способов подумать об этом - это ваш дом. Если вы его никогда не будете убирать и пылесосить, то довольно скоро у вас будет ужасный бардак. Энтропия увеличилась! Чтобы уменьшить ее, необходимо применять энергию для использования пылесоса и швабры, чтобы очистить от пыли поверхность. Дом сам себя не уберет.
Что представляет собой второй закон термодинамики? Формулировка простыми словами гласит, что при изменении энергии из одной формы в другую форму, материя либо движется свободно, либо энтропия (беспорядок) в замкнутой системе увеличивается. Различия в температуре, давлении и плотности имеют тенденцию выравниваться горизонтально через некоторое время. Из-за силы тяжести плотность и давление не выравниваются вертикально. Плотность и давление на дне будут больше, чем сверху. Энтропия - это мера распространения материи и энергии везде, где у нее есть доступ. Наиболее распространенная формулировка второго закона термодинамики в основном связана с Рудольфом Клаузиусом, который говорил:
Невозможно построить устройство, которое не производит другого эффекта, чем перенос тепла из тела с более низкой температурой в тело с более высокой температурой.
Другими словами, все пытается поддерживать ту же температуру с течением времени. Существует много формулировок второго закона термодинамики, в которых используются разные термины, но все они означают одно и то же. Другое заявление Клаузиуса:
Тепло само по себе не происходит от холодного до более горячего тела.
Второй закон применим только к крупным системам. Он касается вероятного поведения системы, в которой нет энергии или материи. Чем больше система, тем более вероятен второй закон.
Еще одна формулировка закона:
Полная энтропия всегда увеличивается в самопроизвольном процессе.
Увеличение энтропии ΔS при протекании процесса должно превышать или быть равным отношению количества теплоты Q, переданного системе, к температуре Т, при которой теплота передается.

Термодинамическая система
В общем смысле формулировка второго закона термодинамики простыми словами гласит, что температурные различия между системами, находящимися в контакте друг с другом, имеют тенденцию к выравниванию и что работа может быть получена из этих неравновесных различий. Но при этом происходит потеря тепловой энергии, а энтропия увеличивается. Различия давления, плотности и температуры в имеют тенденцию выравниваться, если им предоставляется возможность; плотность и давление, но не температура, зависят от силы тяжести. Тепловой двигатель представляет собой механическое устройство, которое обеспечивает полезную работу из-за разницы в температуре двух тел.
Термодинамическая система - это та, которая взаимодействует и обменивается энергией с областью вокруг нее. Обмен и передача должны произойти, по крайней мере, двумя способами. Один путь должен быть передачей тепла. Если термодинамическая система «находится в равновесии», она не может изменять свое состояние или статус без взаимодействия с окружающей средой. Проще говоря, если вы находитесь в равновесии, вы «счастливая система», вы ничего не можете сделать. Если вы что-то захотите сделать, вы должны взаимодействовать с окружающим миром.

Второй закон термодинамики: необратимость процессов
Невозможно иметь циклический (повторяющийся) процесс, который полностью преобразует тепло в работу. Также невозможно иметь процесс, который переносит тепло от холодных объектов на теплые объекты без использования работы. Некоторое количество энергии в реакции всегда теряется для нагревания. Кроме того, система не может преобразовать всю свою энергию в рабочую энергию. Вторая часть закона более очевидна.
Холодное тело не может нагревать теплое тело. Тепло естественным образом стремится течь от более теплых до более прохладных областей. Если тепло перейдет от более прохладного к более теплым, это противоречит тому, что является «естественным», поэтому система должна выполнить некоторую работу, чтобы это произошло. в природе - второй закон термодинамики. Это, пожалуй, самый известный (по крайней мере, среди ученых) и важный закон всей науки. Одна из его формулировок:
Энтропия Вселенной стремится к максимуму.
Другими словами, энтропия либо остается неизменной, либо становится больше, энтропия Вселенной никогда не может снизиться. Проблема в том, что это всегда верно. Если взять флакон духов и распылить его в комнате, то скоро ароматные атомы заполнят все пространство, и этот процесс является необратимым.

Взаимосвязи в термодинамике
В законах термодинамики описываются взаимосвязи между тепловой энергией или теплом и другими формами энергии, и как энергия влияет на материю. Первый закон термодинамики гласит, что энергия не может быть создана или уничтожена; общее количество энергии во Вселенной остается неизменным. Второй закон термодинамики посвящен качеству энергии. В нем говорится, что по мере передачи или преобразования энергии все больше и больше теряется полезной энергии. Второй закон также гласит, что существует естественная тенденция превращения любой изолированной системы в более неупорядоченное состояние.
Даже когда порядок увеличивается в определенном месте, когда вы принимаете во внимание всю систему, включая окружающую среду, всегда наблюдается увеличение энтропии. В другом примере кристаллы могут образовываться из раствора соли, когда вода выпаривается. Кристаллы более упорядочены, чем молекулы соли в растворе; однако испаренная вода гораздо более беспорядочна, чем жидкая вода. Процесс, взятый в целом, приводит к чистому увеличению беспорядка.

Работа и энергия
Во втором законе объясняется, что невозможно преобразовать тепловую энергию в механическую энергию со 100-процентной эффективностью. Можно привести пример с автомобилем. После процесса нагрева газа, чтобы увеличить его давление для привода поршня, в газе всегда остается некоторое количество тепла, которое нельзя использовать для выполнения каких-либо дополнительных работ. Это отработанное тепло должно быть отброшено путем его передачи в радиатор. В случае с автомобильным двигателем это делается путем извлечения отработанного топлива и воздушной смеси в атмосферу.
Кроме того, любое устройство с подвижными частями создает трение, которое преобразует механическую энергию в тепло, которое обычно непригодно и должно быть удалено из системы путем переноса его в радиатор. Когда горячее и холодное тело контактируют друг с другом, тепловая энергия будет поступать из горячего тела в холодное тело до тех пор, пока они не достигнут теплового равновесия. Тем не менее, тепло никогда не вернется в другую сторону; разница температур двух тел никогда не будет спонтанно увеличиваться. Перемещение тепла от холодного тела к горячему телу требует работы, которую должен выполнять внешний источник энергии, такой как тепловой насос.

Судьба Вселенной
Второй закон также предсказывает конец Вселенной. Это конечный уровень беспорядка, если везде будет постоянное тепловое равновесие, никакая работа не может быть выполнена, и вся энергия будет заканчиваться как случайное движение атомов и молекул. По современным данным, Метагалактика - это расширяющаяся нестационарная система, о тепловой смерти Вселенной и речи быть не может. Тепловая смерть - это состояние теплового равновесия, при котором прекращаются все процессы.
Это положение ошибочно, так как второй закон термодинамики применяется только к замкнутым системам. А Вселенная, как известно, безгранична. Однако сам термин «тепловая смерть Вселенной» иногда используется для обозначения сценария будущего развития Вселенной, согласно которому она так и будет расширяться до бесконечности во тьму пространства, пока не обратится в рассеянный холодный прах.
Согласно закону сохранения энергии в случае определенных процессов, объем используемой энергии остается неизменным. Для того, чтобы объяснить как энергия может превращаться можно обратиться к понятию второй закон термодинамики . Данный закон подтверждает необратимость некоторых явлений в природе и указывает траекторию энергетических изменений внутри определенных процессов. Закон был сформулирован на основе наблюдений за происходящее в природе, что позволило понять сущность и характер протекания определенных явлений. Все законы физики основаны на опытах и наблюдениях и позволили формулировать определенные заявления на основе происходящего в природе.
В качестве основы для второго закона термодинамики стали необратимые и непроизвольные процессы, которые происходят исключительно в одно направление и/или без постороннего внешнего воздействия. Классические примеры таких процессов это старение, смерть. Без того чтобы обобщать, можно обратиться к более простым процессам: духи распространяются очень быстро при распылении, а обратному соединению они не подаются; также легко превратить яйца в омлет, так что обратно в скорлупу их невозможно вернуть.
Закон работает в изолированных системах, но также может восприниматься как рабочим в случае систем, у которых есть возможность получить тепло извне. В подобных системах энтропия будет расти даже быстрее. Показатель энтропии указывает на систему с характером неупорядоченности, то есть сама энтропия и есть мера беспорядка. Высокий показатель энтропии это высокий уровень хаотичности движения частиц внутри системы. Классический пример этого состояния это превращение льда в воду и его невозможность стать снова льдом самостоятельно. В случае превращения воды в лед должно происходить понижение уровня энтропии.

Говоря о том, что такое термодинамика второй закон необходимо вспомнить, что собой представляет первый закон термодинамики . Он олицетворение всех известных процессов в природе и соблюдается с 100% точностью. Все что может противоречить этому закону, в природе не существует. Данный закон ничего не отрицает, но и не утверждает, а в качестве вспомогательного элемента для разъяснения определенных процессов вступает второй закон термодинамики, всем известный в разных формулировках. Невзирая на то, что закон простой, он часто интерпретируется некорректно.
Второй закон термодинамики появился, как необходимость определить направление физических процессов определенные первым законом. В первую очередь необходимо отметить, что разные виды энергии обладают различной способностью перевоплощаться в другую энергию. Существует ограничение, которое не позволяет внутренней энергии стать механической энергии и это разъясняется законами термодинамики.

Второй закон термодинамики в различных формулировках
Существует несколько формулировок данного закона, которые объясняют одну правду различными способами. Первый кто сформулировал его это Р. Клаузиус, после последовали формулировки Томсона, Больцмана, Кельвина. Наличие различных интерпретации данного закона позволяет его понять лучше. Поэтому будет не лишним ознакомиться с каждым из них.
1. Переход тепла от тела с невысокой температурой к другому телу с более высоким уровнем температуры невозможен. (Клаузиус)
2. Любой процесс является невозможным, если для его осуществления должно использоваться тепло взятое от постороннего тела.
(Томсон)
3. Состояние энтропии не может стать меньше в полностью закрытых системах, которые не получают никакую внешнюю энергию.
(Больцман)
4. Периодические процессы, происходящие исключительно за счет теплоты единого источника являются невозможными. Создание вечного теплового двигателя, который совершал бы механические процессы за счет потери тепла любого тела, является невозможным. (Кельвин).
Согласно всем формулировкам можно условно определить, что процессы можно называть необратимыми, если механическая энергия проходит путь модификации во внутренней энергии при наличии процесса трения. Отсутствие параметра трение позволило бы в ином случае получать обратное протекание процессов. Обратные процессы можно считать абстрактными с учетом того, что протекают они, как правило, в присутствии реакции теплообмена и трения.

Второй закон термодинамики формулы
Существуют определенные уравнения, которые помогают рассматривать второй закон термодинамики согласно более конкретным данным. Основное уравнение это уравнение Больцмана, которое позволяет вычислять параметр энтропия.
S = Q/ T
С целью понять, что собой представляет параметр энтропия можно рассмотреть пример с системой, в которой два тела с не одинаковой температурой будут обмениваться теплом, пока температура обоих тел не сравнится. Тепло будет передаваться исключительно от тела с температурой выше к более холодному. Тело, которое отдает тепло, получает пониженный уровень энтропии, только не по тем параметрам, по которым увеличиться энтропия тела, получившее это тепло. Энтропия обеих тел по итогам после процесса передачи тепла будет выше для всей системы. Это указывает, что данная величина стремиться к энному максимуму для всех закрытых систем. Также неопровержимо заявление относительно того, что действие по передаче тепла будет продолжать происходить самопроизвольно, пока будут существовать перепады температуры.







 Оладьи из кабачков в духовке Оладушки из кабачков в духовке
Оладьи из кабачков в духовке Оладушки из кабачков в духовке Ремонт в новой квартире во сне
Ремонт в новой квартире во сне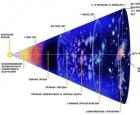 Что было до Большого взрыва?
Что было до Большого взрыва? Пасьянс любит - не любит Любит не любит гадать на картах онлайн
Пасьянс любит - не любит Любит не любит гадать на картах онлайн